双链DNA和RNA是生命体遗传信息的载体,通常呈右手螺旋构象。然而,自然界中也存在左手螺旋构象的核酸,这类核酸片段因其Watson-Crick碱基配对形成的糖磷骨架呈“之”字形(Zigzag)走向的左手双螺旋结构,被称为Z型核酸(Z-NAs),包括Z-DNA和Z-RNA。我们1,2与莫玮课题组3和Balachandran课题组4,5的前期研究表明,Z-RNA和Z-DNA可以通过结合Zα结构域激活ZBP1,进而诱导细胞死亡、抗病毒反应、炎症和抗肿瘤反应。然而,RNA:DNA杂合链是否能形成左手螺旋构象并激活ZBP1诱发细胞死亡和疾病尚无报道。
2025年4月22日,我院焦会朋实验室在Molecular Cell上发表文章“ZBP1 senses spliceosome stress through Z-RNA:DNA hybrids recognition”。该研究发现剪接体是调控内源性Z-RNA:DNA积累的关键检查点,并揭示了ZBP1感知剪接体功能失调诱导细胞凋亡和坏死性凋亡的分子机制。

已有研究表明,剪接体抑制剂Pladienolide-B (Plad-B) 处理能显著上调细胞内RNA:DNA杂合链的积累。为探究RNA:DNA杂合链是否能形成左旋构象并激活ZBP1依赖的细胞死亡,研究团队利用Plad-B处理细胞以提高其RNA:DNA水平。结果显示,Plad-B处理后的细胞表现出强烈的ZBP1依赖性的细胞死亡。其他剪接体抑制剂,如thailanstatin A、Madrasin和isoginkgetin处理细胞后,也观察到不同程度地ZBP1依赖的细胞死亡。
通过突变ZBP1的Zα结构域、使用Caspases和RIPK3抑制剂,或敲除细胞凋亡和坏死性凋亡的关键蛋白(FADD、MLKL和RIPK3),研究团队进一步证实剪接体抑制剂激活了ZBP1 Zα结构域依赖的RIPK3-MLKL介导的坏死性凋亡以及RIPK1-FADD-Caspase 8介导的细胞凋亡信号通路。此外,敲低剪接体关键组分蛋白SF3B1同样能引发ZBP1依赖的细胞死亡,这进一步表明剪接体是调控ZBP1信号通路激活的关键检查点。
为探明剪接体抑制剂激活ZBP1信号通路的机制,研究团队通过免疫荧光和免疫共沉淀等方法发现,该过程主要依赖于左旋核酸在细胞中的上调。为明确左旋核酸的类型,研究团队利用不同核酸酶处理固定后的细胞。结果显示,只有RNase H和RNase A处理能显著降低左旋核酸的荧光信号,而RNase III、RNase T1和DNase I处理无明显效果,这表明RNA:DNA杂合链可能是剪接体抑制剂诱导产生的主要的左旋核酸类型。RNA:DNA杂合链与Zα结构域的共结晶结果显示,两个Zα结构域分别结合于RNA和DNA链的一侧,且RNA:DNA呈现典型的左旋构象。这些证据共同表明,RNA:DNA杂合链能够形成左旋构象并结合Zα结构域,进而激活ZBP1诱导细胞死亡。这些Z-RNA:DNA的序列来源以及剪接体功能失调引起的细胞死亡的生理意义,仍有待进一步研究。
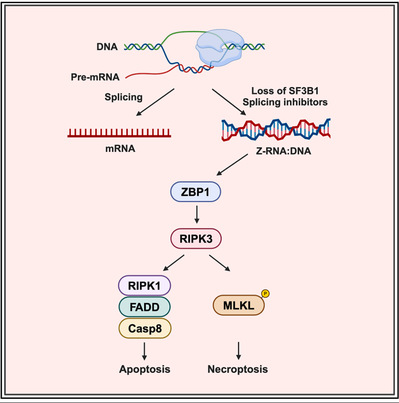
综上所述,本研究从细胞生物学和分子生物学多个层面证实,当剪接体功能受抑制时,细胞内的RNA:DNA杂合链能够呈现左旋构象并激活ZBP1介导的细胞死亡通路。这一发现揭示了RNA:DNA杂合链可作为ZBP1的新型配体诱发细胞死亡,该机制可能与RNA:DNA异常积累相关的疾病有关。
我院博士后何建锋、博士生朱泳伊、田子超和中国海洋大学刘梦琴为本论文共同第一作者,华体会网页版(中国)焦会朋研究员、浙江大学浙江大学医学院公共卫生学院周春研究员和中国海洋大学食品科学与工程学院梁兴国教授为共同通讯作者。良渚实验室陈家明(Francis Kaming Chan)教授、莫玮教授、中科院上海有机化学研究所生物与化学交叉研究中心研究员许代超研究员以及我院的陆华松研究员等同事以及平台对该研究提供了大力支持和建议。该研究受到国家自然科学基金、浙江省杰出自然科学基金、青岛自然科学基金原创探索项目、华体会网页版(中国)启动基金资助。
DOI: 10.1016/j.molcel.2025.04.004
Reference:
1. Jiao, H. et al., Z-nucleic-acid sensing triggers ZBP1-dependent necroptosis and inflammation. Nature (2020).
2. Jiao, H. et al., ADAR1 averts fatal type I interferon induction by ZBP1. Nature (2022).
3. Wang, R., et al., Gut stem cell necroptosis by genome instability triggers bowel inflammation. Nature (2020).
4. Zhang, T. et al., Influenza Virus Z-RNAs Induce ZBP1-Mediated Necroptosis. Cell (2020).
5. Zhang, T. et al., ADAR1 masks the cancer immunotherapeutic promise of ZBP1-driven necroptosis. Nature (2022).